مبانی تئوری خلاء

مبانی تئوری خلاء
مانند هر رشته دیگری، درک اصول علمی زیربنایی وقتی به درستی درک شود، پیامدهای عملی عمیقی دارد. در این سری از مقالات به بررسی مبانی تئوری خلاء می پردازیم و با استفاده از تصاویر دنیای واقعی آنها را توضیح می دهیم.
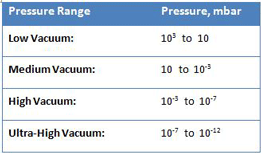
اکثر سیستمهای خلاء صنعتی را میتوان به صورت کلی بر اساس خلاء کم (یعنی «نرم»)، متوسط، زیاد (یعنی «سخت») و فوقالعاده بالا دستهبندی کرد (جدول 1).
این محدوده ها در توصیف فشار، جریان و سایر پدیده های مختلف بسیار مفید هستند که منجر به درک بهتر انتخاب و عملکرد پمپ خلاء و الزامات عملیاتی سیستم در سطوح مختلف خلاء می شود .
همانطور که با تفاوت فشار از خلاء کم تا بسیار زیاد نشان داده می شود، سیستم های خلاء صنعتی باید تحت فشار بسیار گسترده ای کار کنند.
در واقع، دامنه آنقدر زیاد است که درک آن واقعاً دشوار است.
حجمی از گاز را با فشار 1000 میلی بار (فشار اتمسفر) در ظرف 1 متر در 1 متر در 1 متر در بسته در نظر بگیرید تا هیچ مولکولی نتواند فرار کند یا وارد شود.
به راحتی می توان درک کرد که اگر ظرف در حالی که همچنان در بسته باقی می ماند از نظر حجم منبسط شود، به نسبت مستقیم با افزایش حجم (طبق قانون بویل) فشار کاهش می یابد (و خلاء ایجاد می شود).
اگر مثلاً حجم ظرف دو برابر شود و به 2 متر مکعب برسد، فشار به نصف کاهش می یابد و به 500 میلی بار می رسد.
هنگامی که این رابطه به مقیاس سیستم های خلاء صنعتی گسترش یابد، نتیجه قابل توجه است.-12 mbar (خلاء فوق العاده بالا)، کانتینر به طول 99 کیلومتر در عرض 99 کیلومتر و ارتفاع 99 کیلومتر یا 200 برابر حجم گرند کانیون خواهد بود!

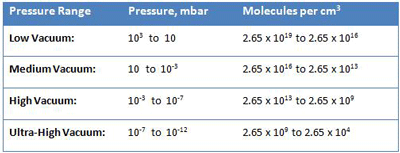
راه دیگر برای درک محدوده فشار عملکرد سیستمهای خلاء صنعتی، در نظر گرفتن چگالی گاز یا تعداد مولکولهای گازی است که در یک حجم معین قرار دارند.
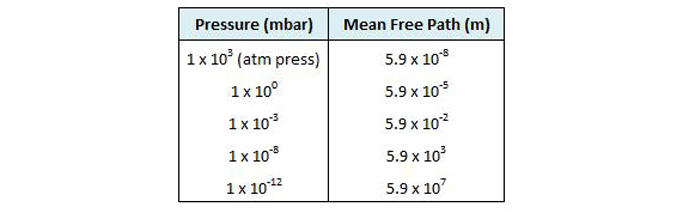
تقریباً 2.65 x 10 19 یا 26,500,000,000,000,000,000 مولکول در یک سانتی متر مکعب گاز در 103 میلی بار وجود دارد که فشار اتمسفر در سطح دریا است (جدول 2). تحت فشار کمتر و پایینتر، مولکولها بیشتر و بیشتر پخش میشوند، تا جایی که در خلاء فوقالعاده بالا ( 10-12 میلیبار )، تنها 2.65 x 104 یا 26500 مولکول در هر سانتیمتر مکعب وجود دارد.
در این چگالی، تقریباً در هر 0.33 میلی متر تنها یک مولکول در فضا وجود دارد.
از آنجایی که قطر هر مولکول گاز بسیار کمتر از این است (4*10 -8برای مثال برای هوا، فضای زیادی بین مولکول ها وجود دارد.
اگر مولکولهای گاز دانههای شن بودند، در خلاء فوقالعاده 1650 متر از هم فاصله داشتند. در این فشارهای بسیار کم، برخورد بین مولکول ها، که به طور معمول خواص گازها را دیکته می کنند، بسیار نادر می شود و مدل نظری متفاوتی برای توضیح خواص آنها مورد نیاز است (به اصطلاح نظریه جنبشی گازها).
نظریه پیوسته و نظریه جنبشی گازها در تئوری خلاء
در فشار اتمسفر یا نزدیک به آن، و در سیستم های غیر خلاء، نظریه به اصطلاح پیوسته به طور دقیق خواص گازها را توصیف می کند.
مبانی تئوری خلاء، به ما می گوید که برخورد بین مولکول های گاز، خواص گاز را دیکته می کند.
تئوری پیوسته چیزی است که ما ماهیت ماکروسکوپیک می نامیم و توسط قوانین گازی مانند قانون گاز ایده آل، قانون بویلز و قانون دالتونز اداره می شود.
- 1 قانون گاز ایده آل: در یک گاز کامل یا ایده آل، تغییر چگالی مستقیماً با تغییر دما و فشار مرتبط است.
- 2 قانون بویلز: فشار اعمال شده توسط جرم معینی از یک گاز ایده آل با حجم اشغال شده آن در دمای ثابت نسبت معکوس دارد.
- 3 قانون فشارهای جزئی دالتون: در مخلوطی از گازهای بدون واکنش، فشار کل اعمال شده برابر است با مجموع فشارهای جزئی هر گاز.
پس از توسعه فناوری پمپ خلاء تا حدی که مولکولهای گاز کمتر و کمتری در یک حجم معین امکانپذیر بود،
اصول حاکم بر خواص این گازها تغییر کرد و ملاحظات مولکولی اصلی شدند. به عبارت دیگر، مولکولهای گاز چنان پخش میشوند که برخوردهای بین مولکولی بین مولکولهای گاز دیگر غالب نبود،
بلکه برخورد با دیوارههای محفظه عامل تعیینکنندهای بود که بر خواص گاز تأثیر میگذاشت.
این منجر به نظریه جنبشی گازها شد که نه تنها در فشارهای پایین (خلاء زیاد) اعمال می شود، بلکه در کل محدوده فشارهایی که در سیستم های خلاء صنعتی مشاهده می شود نیز دقیق است.
چگالی مولکولی و مسیر آزاد متوسط
مفهوم اولیه تئوری جنبشی این است که یک گاز از تعداد زیادی ذره (مولکول) منفرد تشکیل شده است که هر یک به طور جداگانه و تصادفی حرکت می کنند و برخورد بین آنها و همچنین برخورد آنها با دیواره رگ، فشار ایجاد شده توسط ذرات را تعیین می کند. مبانی تئوری خلاء.
گاز. چگالی مولکولی یا تعداد مولکول های گاز در واحد حجم (جدول 2)، متناسب با فشار تغییر می کند.
علاوه بر این، میانگین مسیر آزاد (یا میانگین مسافتی که یک مولکول باید قبل از برخورد با مولکول دیگر طی کند) با کاهش فشار بسیار افزایش مییابد (شکل 2).
مهمتر از همه، افزایش میانگین مسیر آزاد در فشار کاهش یافته، دیکته می کند که برخورد مولکولی با دیواره های رگ، خواص گاز را در فشار کاهش یافته کنترل می کند.
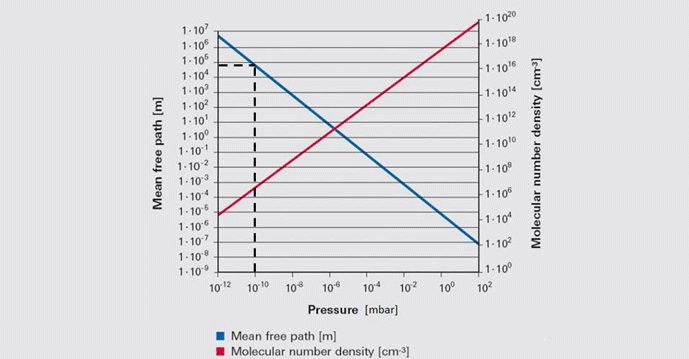
در این شکل توجه داشته باشید که در خلاء فوقالعاده 10-10 میلیبار، میانگین مسیر آزاد نزدیک به 105 یا 100000 متر است.
این بدان معناست که برخورد بین مولکول های گاز به قدری نادر است که هر مولکول باید به طور متوسط 100000 متر را قبل از برخورد تصادفی با مولکول دیگر طی کند.
از آنجایی که دو طرف رگ بسیار نزدیکتر از این است، برخورد با دیواره رگ بسیار بیشتر از مولکول های دیگر است.
بهمین دلیل، در برخوردهای مولکولی خلاء زیاد و فوقالعاده با دیوارههای ظرف (شکل 3) فشار وارد شده توسط گاز بر دیوارههای ظرف را دیکته میکند.
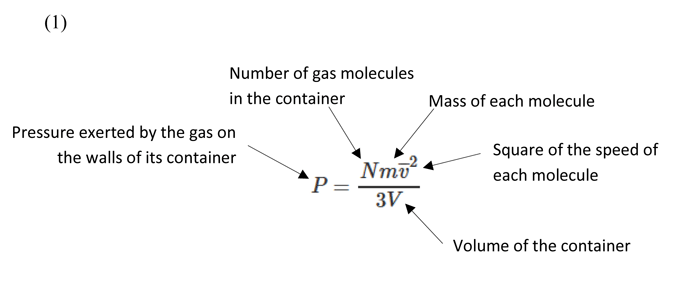
این درک منجر به فرمول بندی فشار گاز به عنوان تابعی از چگالی گاز، سرعت (میانگین مربع) و میانگین مسیر آزاد هر مولکول گاز می شود.
با استفاده از این پایه که به عنوان نظریه جنبشی گازها شناخته می شود، محاسبات فشار، جریان و رسانایی در کل محدوده عملیاتی خلاء به دست می آید.
تئوری گاز جنبشی بر اساس پنج فرض زیر است.
- گازها از تعداد زیادی ذرات تشکیل شدهاند که در حالت حرکت تصادفی و ثابت بهعنوان اجسام غیر کشسان و کروی رفتار میکنند.
- ذرات به صورت خطی حرکت می کنند تا زمانی که با ذره دیگر یا دیواره های ظرف خود برخورد کنند.
- اندازه ذرات نسبت به فضای بین آنها ناچیز است و بنابراین بیشتر حجم گاز را فضای خالی تشکیل می دهد.
- هیچ نیروی جاذبه یا دافعه ای بین ذرات گاز یا بین ذرات و دیواره های ظرف آنها وجود ندارد و بنابراین کل انرژی آنها به سادگی با انرژی جنبشی آنها برابر است.
- برخورد ذرات گاز و برخورد با دیواره کانتینر 100% الاستیک است. هیچ یک از انرژی یک ذره گاز در برخورد با ذره دیگر یا با دیواره های ظرف از بین نمی رود.
با در نظر گرفتن مفروضات فوق، میتوانیم فرمولی (معادله 1) برای توصیف فشار گاز تحت تئوری گاز جنبشی استخراج کنیم.
 تئوری خلاء
تئوری خلاء
موارد فوق به مبانی تئوری خلاء در مکانیک کلاسیک مربوط می شود که در آن انرژی جنبشی = 1/2 mv 2 توسط لایبنیتس و برنولی توسعه داده شد و در ابتدا توسط Gravesande در سال 1722 در مجموعه ای از آزمایشات توصیف شد که در آن توپ های برنجی از ارتفاع های مختلف بر روی یک خاک رس نرم انداخته شدند.
سطح گراوساند دریافت که توپی با سرعت دو برابر توپ دیگر، فرورفتگی چهار برابر عمیقتر از خود به جا میگذارد، که از این نتیجه به این نتیجه رسید که نیروی ایجاد شده توسط جسمی که در حال حرکت است، متناسب با مجذور سرعت آن است.
همین اصل در مورد تئوری گاز جنبشی نیز صدق میکند که در آن نیروی مولکولهایی که بر دیوارههای ظرف تأثیر میگذارند، فشار گاز را متناسب با مجذور سرعت آنها ایجاد میکند.
به عنوان مثال، در نظر گرفتن نیتروژن مفید است، زیرا هوا بیشتر از نیتروژن تشکیل شده است.
هر مولکول نیتروژن مجزا در یک ظرف بسته به سرعت در یک خط مستقیم حرکت می کند، تا زمانی که از مولکول نیتروژن دیگر یا از دیواره ظرف خارج شود، اساساً مانند یک دسته توپ بیلیارد. در دمای گاز 20 درجه سانتیگراد، هر مولکول نیتروژن جداگانه با سرعت متوسط 518 متر در ثانیه یا 1864 کیلومتر در ساعت حرکت می کند.
اگرچه هر مولکول کوچک است، اما نیروی ضربه تجمعی ایجاد شده از تمام مولکول هایی که در هر ثانیه به پوست ما برخورد می کنند (تقریباً 3× 1027 در هر متر مربع) فشار هوای معمولی بر بدن ما است.
در واقع، مولکول های گاز در یک سیستم با طیف وسیعی از سرعت ها حرکت می کنند، اما سرعت متوسط (میانگین) برای اهداف محاسبه فشار و سایر اثرات استفاده می شود.
بعبارت دیگر، مولکولهای همان گاز توزیعی از سرعت را نشان میدهند (شکل 4)، که میانگین آن با قله منحنی نمایش داده میشود. برخی سریعتر حرکت می کنند و برخی دیگر کندتر.
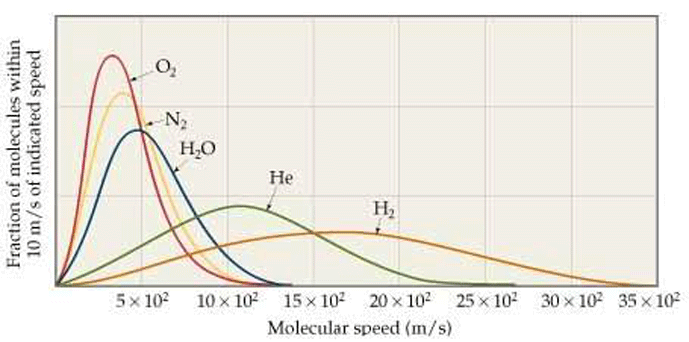
یک نتیجه جالب از توزیع سرعت های مولکولی در یک گاز وجود دارد. با توجه به منحنی زنگی شکل توزیع سرعت، تعداد قابل توجهی مولکول با سرعت بسیار سریعتر (حدود 6 برابر سریعتر) از میانگین وجود دارد.
سرعت فرار از زمین برای هر جسم متحرک (از جمله مولکول های گاز) 11.2 کیلومتر در ثانیه است.
سریع ترین مولکول های نیتروژن 518 × 6 = 3108 متر در ثانیه حرکت می کنند. این به خوبی تحت سرعت فرار است و بنابراین نیتروژن از گرانش زمین نمی گریزد.
از سوی دیگر، مولکول های هیدروژن در جو زمین با سرعت 2700 × 6 = 16200 متر در ثانیه یا 16.2 کیلومتر در ثانیه حرکت خواهند کرد. این بالاتر از سرعت فرار زمین است.
بنابراین سریعترین اتمهای هیدروژن، آنهایی که در دم توزیع هستند، به اندازه کافی پرانرژی هستند که بتوانند بر چنگال گرانش غلبه کنند.پس هیدروژن مانند هلیوم به فضا فرار خواهد کرد.
گرانش زمین گازهای سنگین را حفظ می کند اما گازهای سبک تر به فضا می روند.
در مقاله بالا در مورد نظریه جنبشی گازها و نحوه استفاده از آن برای محاسبه خواص گاز صحبت کردیم. ما همچنین رابطه بین چگالی مولکولی، میانگین مسیر آزاد، سرعت مولکولی و فشار را در نظر گرفتیم. اکنون توجه خود را به بحث در مورد دما و انرژی جنبشی، فشار و انرژی جنبشی و انواع جریان در سیستم های خلاء معطوف می کنیم. مجدداً، با استفاده از مقایسههای اساسی برای توضیح مفاهیم مهم برای سیستمهای خلاء صنعتی، روی اصول اولیه تمرکز خواهیم کرد.
ارتباط دما با نظریه جنبشی گازها در مبانی تئوری خلاء
بر اساس درک اتمی از دنیایی که در آن زندگی می کنیم، نظریه جنبشی نشان می دهد که خواص گاز به شدت به سرعت مولکول های آنها بستگی دارد، که انرژی جنبشی آنها و در نتیجه فشار گاز را تعیین می کند.
هنگام در نظر گرفتن تأثیرات نظریه جنبشی، درک تأثیر دما نیز مهم است. به طور خاص، سرعت مولکولها در یک گاز به دمای آن بستگی دارد (هر چه دما بالاتر باشد، مولکولهای گاز سریعتر حرکت میکنند).
راه دیگری برای فکر کردن به آن این است که دمای یک گاز معیاری از میانگین انرژی جنبشی آن گاز است.
بر اساس نظریه جنبشی، یک گاز از تعداد زیادی مولکول ریز تشکیل شده است که همگی در حرکت تصادفی ثابت هستند و به طور کشسانی با یکدیگر و کشتی حاوی آنها برخورد می کنند.
فشار نتیجه خالص نیروی ضربه این برخوردها به دیواره رگ است. سرعت مولکول ها در طول این حرکت به هیچ وجه تصادفی نیست، اما از یک منحنی زنگی پیروی می کند، با توزیع قابل پیش بینی در مورد میانگین.
سرعت مولکولی به وزن مولکول ها و دمای آنها یا انرژی گرمایی ذاتی بستگی دارد. بنابراین برای یک گاز معین، انرژی گرمایی موجود در مولکول های آن، سطح انرژی و در نتیجه سرعت آنها را تعیین می کند.
برای درک کامل تأثیر دما بر گاز، درک درجه کلوین (که به طور صحیح تر به صورت کلوین تعریف می شود) مفید است، که مقیاس دمای مطلق است (درجه بالاتر از به اصطلاح صفر مطلق که در آن همه حرکت متوقف می شود).
این یک اندازه گیری واقعی انرژی جنبشی است.
از آنجایی که هیچ دمایی کمتر از صفر و حجمی کمتر از صفر وجود ندارد، صفر مطلق کمترین دمای ممکن است، جایی که تمام حرکت جنبشی متوقف می شود و حجم گاز به صفر کاهش می یابد.
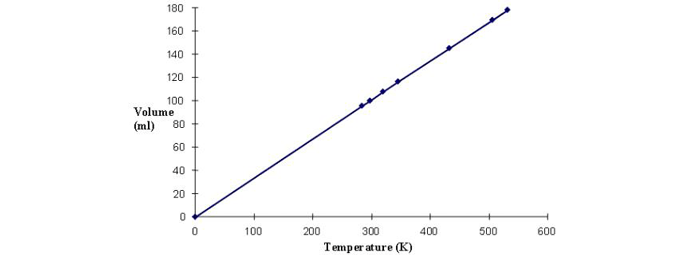
زمانی که حجم یک گاز در چندین دما مختلف اندازه گیری و ترسیم می شود این امر به اثبات می رسد (شکل 1).
هنگامی که نمودار به 0 K گسترش می یابد، حجم به صفر می رسد. به خاطر داشته باشید که حجم مولکول های گاز به صورت جداگانه صفر نیست، اما فضای بین مولکول ها به صفر نزدیک می شود.
اگرچه صفر مطلق هرگز به دست نیامده است، اما در نمونه های کوچک دمایی به اندازه یک میلیاردم کلوین به دست آمده است.
برای مقایسه بین واحدها، رابطه بین K و °C را در نظر داشته باشید که در آن صفر مطلق برابر با 273.16- درجه سانتیگراد (460.67- درجه فارنهایت) است. با درک دمای مطلق، میتوان تأثیر دما بر حجم و فشار گاز را مورد بحث قرار داد.
مشاهده می شود که برای یک گاز معین، با افزایش دمای آن، سرعت متوسط مولکول های آن به نسبت جذر دمای مطلق آن افزایش می یابد.
برای مثال نیتروژن را در نظر بگیرید (شکل 2). در دمای 300 کلوین (27 درجه سانتیگراد یا 81 درجه فارنهایت) مولکولهای آن به طور متوسط 400 متر در ثانیه (1312 فوت در ثانیه یا 894 مایل در ساعت) حرکت می کنند.
هنگامی که دمای مطلق با ضریب 4 افزایش می یابد و به 1200 کلوین (927 درجه سانتیگراد یا 1700 درجه فارنهایت) می رسد، سرعت مولکولی متوسط آن با ضریب 2 (که جذر 4 است) به 800 متر در ثانیه افزایش می یابد. (2624 فوت در ثانیه یا 1789 مایل در ساعت).
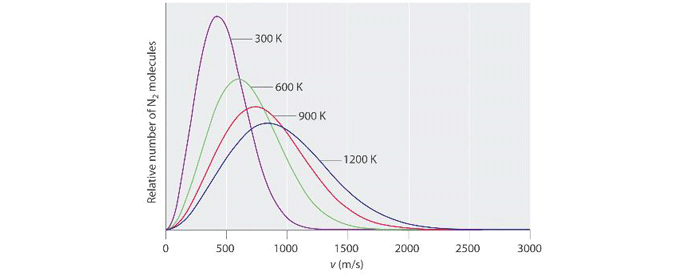
همچنین در شکل 2 توجه داشته باشید که در دماهای پایین تر، منحنی ها باریک تر و بلندتر هستند.
در دماهای بالاتر، توزیع گستردهتری از سطوح انرژی (و سرعتهای مولکولی مربوطه) در بین جمعیت مولکولها وجود دارد. در دماهای پایینتر، تنوع کمتری بین سرعت مولکول های مختلف وجود دارد و بنابراین منحنی در قاعده آن باریک تر است.
هنگامی که دمای (مطلق) یک گاز به عنوان معیاری از انرژی جنبشی آن در نظر گرفته شود، مفاهیم نظریه جنبشی گازها در رابطه با دما روشن می شود.
به یاد بیاورید که تحت نظریه جنبشی گازها، فشار وارد شده توسط یک گاز مجموع نیروی اعمال شده توسط تمام ضربه های فیزیکی بین مولکول های گاز و ظرف (یا محفظه خلاء یا لوله های خلاء و غیره) حاوی آن است.
از آنجایی که سرعت مولکولها مستقیماً با (مربع) دما مرتبط است، فشار گاز نیز با جذر دمای مطلق آن رابطه مستقیمی با دما دارد.
تأثیر دما بر فشار همانطور که توسط نظریه جنبشی توصیف شده است را می توان با یک آزمایش ساده با استفاده از بالون حزبی و نیتروژن مایع نشان داد (شکل 3).
هنگامی که بالون باد شده به طور موقت در ظرفی از نیتروژن مایع که در دمای 77 کلوین (196- درجه سانتیگراد یا 320- درجه فارنهایت است) غوطه ور می شود، مولکول های هوای داخل آن بلافاصله دما کاهش می یابد و انرژی جنبشی خود را از دست می دهند. سرعت کاهش می یابد).
در نتیجه کاهش سرعت مولکولی، دو اتفاق می افتد. (الف) برخورد بین مولکول ها کمتر می شود و فضای بین آنها کاهش می یابد و (ب) نیروی برخورد مولکول ها با ظرف خود (بالون) کاهش می یابد و فشار هوا بر بالون کاهش می یابد.
این باعث کوچک شدن بالون می شود. حجم کاهش یافته هوا متناسب با دمای مطلق آن است.

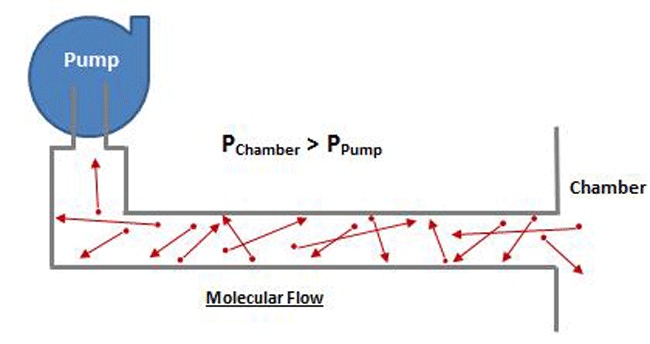
انواع جریان در سیستم های خلاء; پیوسته، مولکولی و نادسن مبانی تئوری خلاء
نحوه جریان گاز در سیستم خلاء به فشار گاز بستگی دارد.
در فشارهای خلاء خشن بالای تقریباً 1 میلی بار (0.015 PSI)، جریان پیوسته (یا چسبناک) غالب است.
در این فشارها، مولکول ها نسبتا نزدیک به هم هستند و برخورد آنها بیشتر است.
بنابراین جریان توسط برهمکنش بین مولکول ها کنترل می شود.
در نتیجه، کل حجم گاز، یا گروهی از مولکولها را میتوان برای حرکت در یک حرکت منظم، یعنی جریان (شکل 4). این حرکت مرتب شده بر حرکت تصادفی طبیعی تک تک مولکول ها سوار می شود یا به آن اضافه می شود.
گاز در این فشارها را می توان به عنوان دارای ویسکوزیته یا چسبندگی در نظر گرفت که به دلیل اصطکاک داخلی بین مولکول ها امکان حرکت منظم آنها را فراهم می کند.
بنابراین سرعت و جهت ترجیحی جریان مولکول مانند جریان گاز ماکروسکوپی خواهد بود.

از سوی دیگر، جریان مولکولی در فشارهای زیر 001/0 میلیبار (000015 PSI) مشاهده میشود که در محدوده خلاء بالا و فوقالعاده قرار دارد.
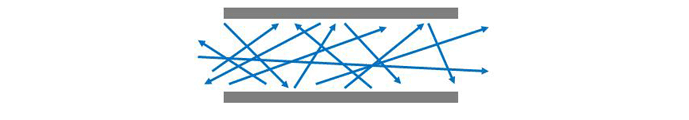
در این فشارها، به دلیل اینکه فضای زیادی بین مولکول های گاز وجود دارد، برخوردهای بین مولکولی بسیار کمتر است (شکل 5). مولکول ها آزادانه و بدون هیچ گونه تداخل متقابل حرکت می کنند و بنابراین هیچ جریان گروهی منظمی امکان پذیر نیست.
مولکول ها به طور جداگانه در یک خط مستقیم بدون برخورد حرکت می کنند تا زمانی که به دیواره رگ یا لوله حاوی آنها برخورد کنند.
جریان مولکولی در جایی وجود دارد که میانگین طول مسیر آزاد (متوسط مسافتی که یک مولکول قبل از برخورد با مولکول دیگر باید طی کند) بسیار بزرگتر از قطر لوله ای است که گاز از آن عبور می کند و بنابراین مولکول ها آزادند تا زمانی که با مولکول برخورد کنند. دیوارهای لوله به عنوان یک نتیجه،
در محدوده انتقالی بین جریان پیوسته و جریان مولکولی، جریان نادسن غالب است. در این محدوده هم برخورد دیواره و هم برخورد بین مولکولی در تعیین ویژگی های جریان تأثیرگذار هستند.
فناوری پمپ در محدوده جریان پیوسته و مولکولی
پمپهای خلاء که در محدوده جریان پیوسته (ویسکوز) کار میکنند، مانند دمندههای ریشه، پمپهای پیچی، پمپهای پنجهای و پمپهای پرهای چرخشی با حرکت دادن مولکولها به صورت گروهی عمل میکنند.
آنها این مزیت را دارند که از برهمکنش بین مولکول ها (کیفیت چسبناک گاز) به نفع خود استفاده می کنند.
آنها یک مکش ایجاد می کنند تا حجم گاز را به ورودی پمپ بکشند، سپس آن را از مکانیزم پمپ عبور داده و در فشار اتمسفر خارج کنند.
در نتیجه آنها می توانند توان عملیاتی بالایی ایجاد کنند و در فازهای خشن و خلاء کم، تخلیه سریع را فراهم کنند.
پمپ هایی که برای ایجاد خلاء زیاد و فوق العاده بالا استفاده می شوند شامل پمپ های انتشار، پمپ های برودتی و پمپ های یونی هستند و باید در محدوده جریان مولکولی کار کنند.
بنابراین از فناوری های متفاوتی نسبت به پمپ های خشن و کم خلاء استفاده می کنند.
از آنجایی که هیچ جریان ماکروسکوپی واقعی در محدوده مولکولی وجود ندارد، پمپهای مورد استفاده در خلاء زیاد و فوقالعاده نمیتوانند گاز را از محفظه خلاء خارج کنند.
در عوض نحوه عملکرد آنها این است که به سادگی مولکول هایی را که به طور تصادفی وارد ورودی پمپ می شوند جذب کنند.
در نتیجه، زمانی که فشار محفظه به محدوده خلاء زیاد و فوقالعاده میرسد، تخلیه بسیار کندتر میشود و کار پمپ دشوارتر میشود.
به منظور درک عملکرد یک پمپ در محدوده جریان مولکولی، مفید است که مولکول ها را در یک محفظه خلاء به عنوان توپ های بیلیارد روی میز بیلیارد تصور کنیم (شکل 6) که تنها یک جیب باز دارد که ورودی پمپ را شبیه سازی می کند.
اگر توپها همه در جهتهای تصادفی حرکت کنند، مثلاً پس از استراحت، اما اجازه داشته باشند بدون کاهش سرعت از روی ضربهگیرها بپرند (همانطور که مولکولهای گاز پس از برخورد با دیوارههای اتاقک انجام میدهند)، برخی از آنها شروع به سقوط میکنند.
داخل جیب از آنجایی که جیب توانایی “کشیدن” توپ ها را به سمت خود ندارد، بر این تکیه می کند که یک توپ در آن اتفاق بیفتد.
در ابتدا، در حالی که توپ های بیشتری وجود دارد، احتمال زیادی وجود دارد که یک توپ در جیب بیفتد و توپ ها به سرعت خارج می شوند.
همانطور که تعداد بیشتری از توپ ها به جیب می افتند، تعداد کمتر و کمتری از آنها باقی می ماند و احتمال افتادن توپ در جیب را کاهش می دهد.
در نهایت فقط چند توپ باقی می ماند و احتمال افتادن توپ در جیب بسیار کم می شود.
در این مرحله، حذف بیشتر توپ بسیار بعید است و برای اهداف عملی، هیچ توپ دیگری در مدت زمان معقول حذف نخواهد شد. معادل خلاء فوق العاده بالا به دست آمده است
قبلاً در این مقاله، در مورد نظریه جنبشی گازها صحبت کردیم و به طور خاص نشان دادیم که چگونه حرکت اتم ها بر اصولی مانند
چگالی مولکولی، میانگین مسیر آزاد و سرعت مولکولی تأثیر می گذارد و چگونه از آنها برای تجزیه و تحلیل خواص ماکروسکوپی گازها استفاده می شود.
مانند فشار، دما و جریان در محیط خلاء. در زیر موضوع مربوط به جریان گاز، سرعت گاز، رسانایی، انتشار و افیوژن را با تمرکز بر مفاهیم اساسی مورد بحث قرار خواهیم داد.
سرعت جریان گاز در مبانی تئوری خلاء
هنگام طراحی و استفاده از سیستم های خلاء، بسیار مهم است که بتوانیم زمان مورد نیاز برای کاهش فشار به سطح مورد نظر را پیش بینی کنیم. به کمک مبانی تئوری خلاء
از آنجایی که این زمان به طور مستقیم با سرعت جریان گاز در سیستم ارتباط دارد، بنابراین مهم است که بفهمیم چه چیزی بر سرعت جریان گاز تأثیر می گذارد.
از اهمیت عملی تأثیر قطر لوله، خمش لوله و وسایلی مانند فیلترها و کندانسورها برخوردار است.
پدیده های جریان به راحتی قابل درک نیستند مگر اینکه خواص متفاوت گاز در محدوده جریان مولکولی و پیوسته در نظر گرفته شود.
جریان خفه شده (مسدود)
در نرخهای جریان کم در پیوستار، یا محدوده چسبناک جریان گاز (که در فشارهای بیش از 1 میلیبار اتفاق میافتد)، نرخ جریان از طریق لوله یا روزنه مستقیماً با اختلاف فشار در سراسر لوله یا روزنه متناسب است.
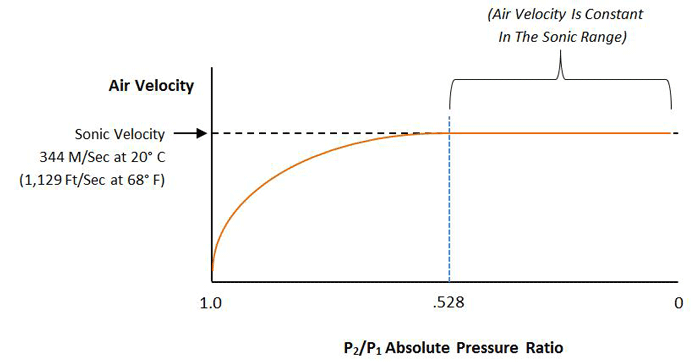
این زمانی تغییر می کند که سرعت جریان گاز به سرعت صوت می رسد که به آن سرعت صوتی (تقریباً 1223 کیلومتر در ساعت یا 760 مایل در ساعت) می گویند که سرعت صوت در آن گاز است.
افزایش بیشتر فشار باعث افزایش دبی نمی شود (شکل 7). این وضعیت به عنوان جریان خفه نامیده می شود.
جریان خفه زمانی اتفاق میافتد که اختلاف فشار در سرتاسر دهانه، یا از طریق لوله، به گونهای باشد که فشار روی نسبت بین سمت فشار بالا و سمت کم فشار روزنه به مقدار مشخصی خاص برای آن گاز برسد.
برای هوا این مقدار 52.8٪ است (P IN / P OUT = 0.528).
این امر هنگام تهویه یک محفظه خلاء از اهمیت حیاتی برخوردار است.
هنگامی که دریچه باز می شود، هوا با فشار اتمسفر با سرعتی بیشتر از صوت به داخل محفظه جریان می یابد، مهم نیست که فشار داخل محفظه چقدر کم باشد.
با ادامه تهویه و پر شدن محفظه با گاز، فشار داخل محفظه افزایش می یابد تا به P ATM x 0.528 یا 528 mbar (7.76 psi) برسد. پس از افزایش نسبت فشار از این نقطه، سرعت جریان متناسب با اختلاف فشار در سراسر دریچه می شود.
نکته اصلی این است – از آنجایی که نمی توان سرعت جریان گاز را بالاتر از سرعت صوتی افزایش داد، تنها راه برای افزایش سرعت هواگیری یک محفظه استفاده از یک دریچه بزرگتر است.
هدایت
طبق مبانی تئوری خلاء رسانایی مشخصه یک جزء خلاء یا لوله برای “رسانایی” گاز از طریق سیستم است. مشابه سیستم های الکتریکی، که در آن رسانایی یک سیم اجازه می دهد تا الکترون ها را از طریق مداری که توسط پتانسیل الکتریکی ایجاد می شود، عبور دهد،
رسانایی در یک سیستم خلاء جریان مولکول های گاز را از طریق یک سیستم خلاء ناشی از اختلاف فشار تولید شده توسط پمپ، اجازه می دهد.
هنگام انتخاب پمپ خلاء و سایر اجزاء باید رسانایی را به دقت در نظر گرفت تا از کاهش نرخ پمپاژ و طولانی شدن زمان تخلیه جلوگیری شود.
ظرفیت پمپ باید برای سازگاری با مقاومت یا معکوس رسانایی افزایش یابد.
رسانایی دارای واحدهای دبی حجمی تقسیم بر افت فشار است که به صورت لیتر در ثانیه یا فوت مکعب در دقیقه بیان می شود. رسانش بین دو نقطه به عنوان نرخ جریان گازی که در یک دستگاه جریان می یابد تقسیم بر افت فشار حاصل تعریف می شود.
رسانایی در ناحیه جریان ویسکوز (Cv)، در ناحیه جریان مولکولی (Cm) کمترین مقدار و در ناحیه جریان انتقالی (Ct) رسانایی بیشتر است.
بعبارت دیگر Cm < Ct < Cv. مقاومت جریان (رسانایی متقابل) در محدوده جریان مولکولی، در خلاء بالاتر، کمترین مقدار را در محدوده جریان ویسکوز، در خلاء کمتر دارد.
این ممکن است غیر منطقی به نظر برسد زیرا گاز در فشارهای بالاتر چگالتر و در خلاء بالاتر چگالی کمتری دارد.
چرا پمپاژ گاز در حالت چگال تر آسان تر و در حالت چگالی کمتر پمپاژ آن دشوارتر است؟ پاسخ در تعامل مولکول های گاز در محدوده جریان چسبناک در مقابل جریان مولکولی نهفته است.
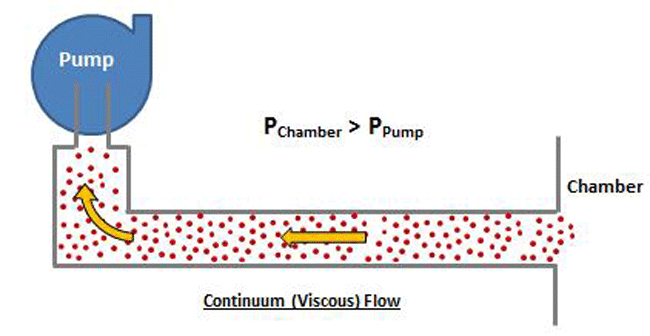
در فشار بالاتر، جایی که جریان چسبناک رخ می دهد، مولکول های گاز نسبتا نزدیک به هم هستند و به صورت گروهی حرکت می کنند.
توجه داشته باشید که در شکل 8 فشار محفظه بیشتر از فشار ورودی پمپ خلاء است. در محدوده جریان چسبناک، برخورد بین مولکولها مکرر است، زیرا آنها نسبتاً نزدیک به هم هستند و هنگامی که اختلاف فشار اعمال میشود، مولکولها به صورت گروهی حرکت میکنند.
از سوی دیگر، در محدوده مولکولی (شکل 9)، مولکول ها به قدری پراکنده هستند که برخوردها بسیار نادر است. بنابراین هنگامی که فشاری بر انتهای محفظه لوله وارد می شود، مولکول ها نمی توانند یکدیگر را از طریق لوله “هل” کنند زیرا تقریباً هرگز با هم برخورد نمی کنند، بلکه به طور مستقل حرکت می کنند.
پمپ باید به حرکت تصادفی مولکول ها برای ورود به ورودی پمپ تکیه کند، در این زمان آنها به سادگی گرفته می شوند.
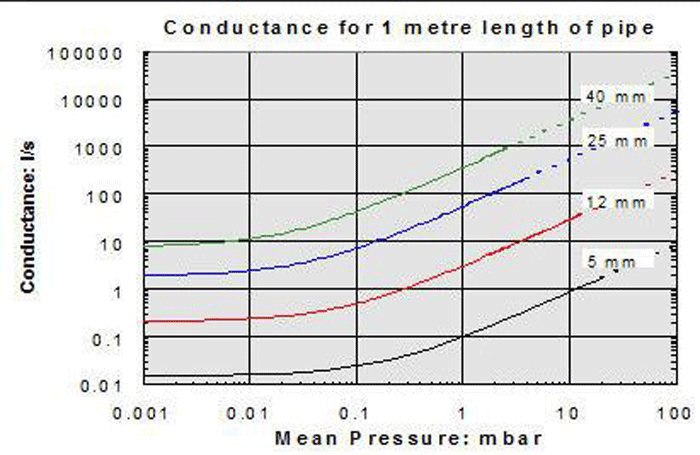
چند واقعیت ضروری در مورد هدایت که ارزش بررسی دارد:
1. رسانایی را می توان برای یک سیستم محاسبه کرد. هدایت لوله معمولاً از مقادیر نمودار گرفته می شود و به قطر لوله، طول لوله، سرعت جریان و فشار بستگی دارد. مقادیر رسانایی برای قطعاتی مانند شیرها، فیلترها و تلهها توسط سازندگان آنها منتشر شده و بر اساس مقادیر تجربی است.
2. رسانایی در طول سه حالت جریان از طریق سیستم تغییر می کند: جریان پیوسته، جریان مولکولی و جریان نادسن (انتقال بین این دو). به یاد بیاورید که جریان پیوسته در فشار بالاتر (خلاء کم) و مولکولی در فشار کمتر (خلاء زیاد) رخ می دهد. بنابراین رسانایی یک جزء خلاء معین یک مقدار ثابت نیست اما با فشار سیستم تغییر می کند. بنابراین، هنگام محاسبه رسانایی، باید توجه داشت که فقط مقادیر رسانایی قابل اعمال برای یک محدوده فشار خاص ممکن است در آن محدوده اعمال شود.
3. برای انتخاب پمپ خلاء، لازم است رسانایی کل سیستم در حال طراحی محاسبه شود. این معمولاً به صورت تقریبی انجام می شود و یک فاکتور ایمنی اضافه می شود. سپس پمپ را می توان برای ارائه دبی مورد نظر در هر محدوده فشار انتخاب کرد و جریان تجمعی را در طول زمان تعیین کرد.
4. در ناحیه جریان مولکولی، مقدار رسانایی مستقل از فشار است (شکل 10). منحنی ها در محدوده فشار پایین تر صاف می شوند. به عبارت دیگر، در خلاء زیاد و فوق العاده بالا، رسانایی در فشارهای مختلف ثابت می ماند. این مورد در محدوده پیوسته و نادسن نیست، جایی که رسانایی به شدت به فشار وابسته است.
5. هندسه سیستم:
الف. لوله کشی با طول کوتاه و قطر بزرگتر بهترین است
ب منیفولد و قطر لوله کشی باید برابر یا بیشتر از ورودی پمپ خلاء
باشد c. سیستم پمپاژ باید از نظر فیزیکی تا حد امکان نزدیک به محفظه
د. تعداد خم ها، آرنج ها و چرخش ها باید به حداقل برسد.
مبانی تئوری خلاء
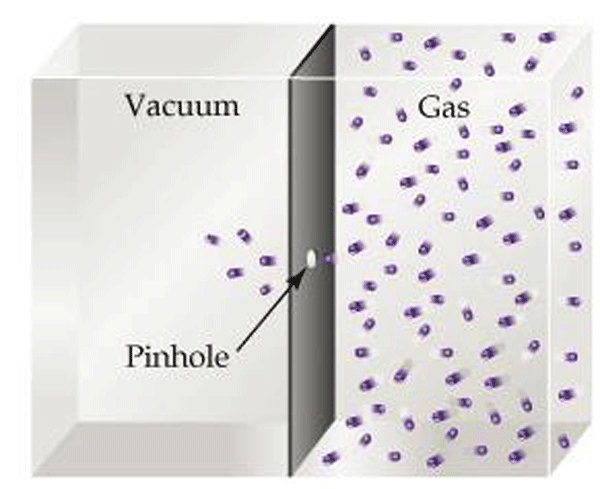
افیوژن
افیوژن روشی را توصیف می کند که در آن گازها از یک سوراخ کوچک از ناحیه ای با فشار بالاتر به فشار کمتر عبور می کنند (شکل 11). این به سیستم های خلاء مربوط می شود زیرا عملکرد نشت خلاء را در شرایط خلاء بالا هنگامی که جریان مولکولی غالب است توضیح می دهد.
به منظور درک افیوژن، مانعی بین ناحیه ای با فشار کم (خلاء زیاد) و فشار بالا در نظر بگیرید (شکل 11). اگر یک سوراخ بسیار کوچک (قطر کوچکتر از مسیر میانگین ریشه) در مانع ایجاد شود،
طبق مبانی تئوری خلاء حرکت جنبشی مولکولهای گاز حکم میکند که مولکولها زمانی که مسیرشان به طور تصادفی از سوراخ عبور میکند، از سوراخ عبور کنند. به یاد بیاورید که ریشه میانگین مسیر (جدول 1) مسافتی است که یک مولکول گاز قبل از برخورد با مولکول دیگر طی می کند.
مسیر میانگین ریشه در محدوده فشاری که سیستم های خلاء عمل می کنند بسیار متفاوت است. از آنجایی که در خلاء زیاد، هر سوراخ یا نشتی در سیستم خلاء کوچکتر از این فاصله است، گاز با حرکت منظم و گروهی از سوراخ عبور نمی کند. بلکه با گذشت زمان این حرکت تصادفی باعث می شود تا در نهایت برخی از ذرات از سوراخ عبور کنند.
قوانین گراهام حکم می کند که سرعت انتشار گاز برای گازهای سبک تر از گازهای سنگین تر است. این به دلیل این واقعیت است که مولکول های سبک تر سریعتر حرکت می کنند.
از آنجایی که تنها راه فرار یک مولکول از ظرف خود این است که “به سوراخ” برخورد کند، هر چه مولکول ها سریعتر حرکت کنند، احتمال برخورد مولکول به سوراخ و ترشح بیشتر است. بنابراین هیدروژن و هلیوم که وزن مولکولی کم و سرعت بالایی دارند، بسیار سریعتر از هوا از نشت عبور می کنند.
افیوژن همچنین می تواند برای توصیف نحوه ورود مولکول ها به پمپ خلاء بالا استفاده شود. از آنجایی که قطر پمپ خلاء برای فشارهای کمتر از 4-10 میلیبار از میانگین مسیر آزاد بیشتر خواهد بود ،
اساساً تمام مولکولهایی که به ورودی میرسند ادامه میدهند و به داخل پمپ میروند زیرا برخورد بین مولکولها در ناحیه ورودی ناچیز است. .
اصطلاح افیوژن همچنین به روشن شدن روشی که در آن پمپهای خلاء بالا مولکولهای وارد شده به پمپ را جمعآوری میکنند، به جای مکیدن مولکولها به سمت ورودی کمک میکند.
میتوان گفت که مولکول ها از طریق ورودی پمپ نفوذ می کنند.
انتشار
طبق نظریه جنبشی گازها، و مبانی تئوری خلاء مولکول های گاز در یک حرکت تصادفی ثابت هستند و با سرعت های مختلف و در جهات مختلف حرکت می کنند.
بدلیل انرژی جنبشی آنها در دماهای بالاتر از صفر مطلق، همه ذرات تحت انتشار یا حرکت از ناحیه ای با غلظت بالا به ناحیه ای با غلظت پایین قرار می گیرند.
سرعت این حرکت با دما، ویسکوزیته محیط و جرم مولکول ها مرتبط است. انتشار باعث اختلاط تدریجی گازهای مختلف می شود.
اصل انتشار از چند جهت با حوزه فناوری خلاء ارتباط دارد.
اول، انتشار وسیله ای که توسط آن مولکول های گاز از یک ماده جامد عبور می کنند تا فرآیند خلاء را آلوده کنند.
حتی اگر بتوان اجزای یک سیستم خلاء را بدون نشتی فیزیکی طراحی کرد، همچنین دریچهها و سایر اجزایی که به طور مکانیکی کاملاً آببندی میشوند،
مولکولهای کوچکی مانند هلیوم میتوانند در مهر و مومهای پلیمری و حتی دیوارههای فلزی محفظههای خلاء نفوذ کنند.
استراتژی های مختلفی برای غلبه بر این مورد استفاده می شود، از جمله تکیه بر پمپ خلاء برای حذف ساده مولکول های مهاجم و استفاده از مواد با ثابت نفوذ بهتر.
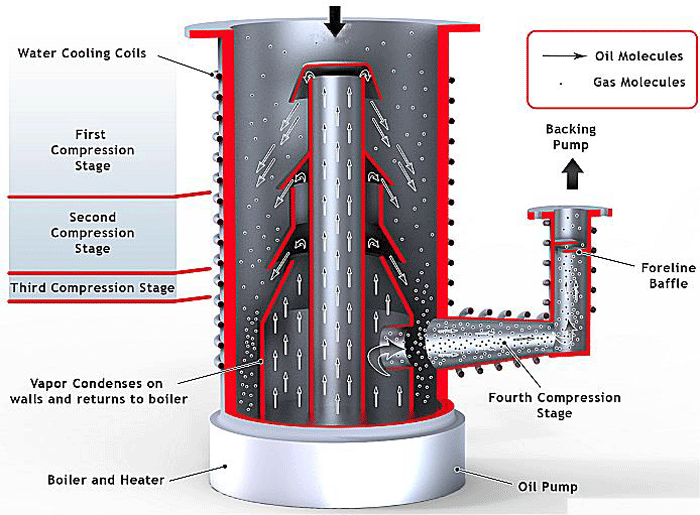
ارتباط دیگر انتشار در سیستم های خلاء شامل پمپ انتشار است (شکل 12) که معمولاً برای دستیابی به خلاء بالا استفاده می شود.
اصل عملکرد آن بر انتشار مولکول های گاز پمپ شده در محیط پمپ مانند روغن یا پلیمر است.
تمام پمپهای خلاء بالا به جذب مولکولهای گاز متکی هستند و پمپهای انتشار میتوانند با حفظ غلظت کم مولکولهای گاز منتشر شده در محیط پمپاژ، مولکولها را جذب کنند.
سپس مولکول های گاز پمپ شده از طریق تراکم از محیط خارج می شوند و به این محیط تمیز شده دائماً دوباره وارد می شود که با جلوگیری از اشباع شدن محیط با گاز باعث انتشار بیشتر گاز می شود.